
香川大学医学部附属病院 脳神経内科診療科長
出口 一志
———————————————————————————
デバイスを用いた治療(device aided therapy)
パーキンソン病の治療を開始して5年程度が経過すると、内服効果の
持続時間の短縮(ウェアリング・オフ現象)や自分の意志とは無関係に
勝手に体が動く現象(ジスキネジア)が、多くの患者さんにみられるよう
になります。このような状態の改善には、持続的にドパミンの血中濃度を
ちょうど良いレベルに保つことが有効と考えられています。それを達成
するために、レボドパ製剤を1日4~5回内服する、ドパミン受容体刺激薬
の増量、ドパミン受容体刺激薬の速放剤から徐放剤や貼付剤への変更、
COMT阻害薬やMAO-B阻害薬、アデノシンA2A受容体拮抗薬、ゾニサミド
の併用が行われています。
以上の内服薬の調整を行っても、効果が不十分であり、レボドパ内服が
1日5回以上必要またはオフ時間が1日1~2時間以上ある場合には、デバ
イスを用いた治療を検討する場合があります。デバイス(device)とは、
機器、装置といった意味で、3つの方法が考案されていますが、現在、国
内で治療に用いられている方法は以下の2つです。
1) 脳深部刺激療法(deep brain stimulation: DBS)

DBS療法
日本メドトロニック資料から引用
胸壁下に埋め込まれた刺激発生装置から、脳内(視床下部、淡蒼球
内節、視床腹中間核のいずれか)に留置された電極を介して電気刺激
を行い、大脳基底核での異常な神経活動パターンを調整することに
よって効果を発揮します。視床下部への刺激は、オフ症状(四肢の無動
や固縮)の改善、振戦の抑制・軽減に有効であり、抗パーキンソン病薬
の減量も期待できます。薬剤が減量できれば、ジスキネジアを軽減させ
ることも可能となります。淡蒼球内節への刺激は、オフ症状(四肢の無
動や固縮)を改善し、ジスキネジアを直接的に抑制します。視床腹中間
核への刺激は、薬物療法抵抗性の振戦に対して行われます。
DBSの効果とレボドパの効果は相関があり、DBSはレボドパが有効な
症状(四肢の無動や固縮)には効果が期待できますが、レボドパの効果
が乏しい症状(発声や嚥下、すくみ足、易転倒性など)には十分な効果
が得られません。DBS治療効果の予測として、一晩、休薬した後、翌朝
に普段内服している抗パーキンソン病薬1回分の1.5倍相当量のレボドパ
を静脈内投与する方法が用られます(レボドパチャレンジテスト)。
投与前後で運動機能のスコアが30%以上改善すれば、DBSによる運動機能
改善が期待できます。
DBSは認知機能低下やコントロール不能の精神症状がある患者さんに
は行うことができません。この点からDBSは概ね70歳以下の患者さんへ
の実施が適した治療といえます。
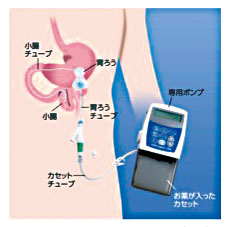
2)レポドパ/カルビドパ経腸溶液
(L-dopa/carbidopa intestinal gel:LCIG)
胃瘻を造設し、ポンプを用いてゲル状のレボドパ製剤を空腸内に持続
的に投与する方法で、血液中のドパミン濃度をちょうど良いレベルに保
つことが可能となる方法です。1日の合計投与量の上限および投与時間
(16時間まで)に制限があるため、日中の活動時間帯に投与が行われ
ます。症状の悪化時には決められた量の範囲内で追加投与が可能です。
LCIGによる最善の治療効果は、レボドパ内服による最善の治療効果と
同等であることから、LCIG導入の条件として、レボドパに十分な反応
性があり、オン時は日常生活動作が保たれていることが挙げられます。
このような条件を満たしているかどうかの評価には、DBSのところで
述べたレボドパチャレンジテストが用いられます。
LCIG療法
アッブィ資料から引用